внешняя ссылка
Соли и ковалентные производные нитрат ион
| HNO3 | Он | ||||||||||||||||
| LiNO3 | Быть (НЕТ3)2 | B (НЕТ3)−4 | РОНО2 | Нет−3NH4Нет3 | HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg (НЕТ3)2 | Al (НЕТ3)3 | Si | п | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca (НЕТ3)2 | Sc (НЕТ3)3 | Ti (НЕТ3)4 | VO (НЕТ3)3 | Cr (НЕТ3)3 | Mn (НЕТ3)2 | Fe (НЕТ3)2Fe (НЕТ3)3 | Co (НЕТ3)2Co (НЕТ3)3 | Ni (NO3)2 | CuNO3Cu (NO3)2 | Zn (НЕТ3)2 | Ga (НЕТ3)3 | Ge | В качестве | Se | Br | Kr |
| RbNO3 | Sr (НЕТ3)2 | Д (НЕТ3)3 | Zr (НЕТ3)4 | Nb | Пн | Tc | Ru (NO3)3 | Rh (НЕТ3)3 | Pd (НЕТ3)2Pd (НЕТ3)4 | AgNO3Ag (НЕТ3)2 | CD (НЕТ3)2 | В (NO3)3 | Sn | Sb (НЕТ3)3 | Te | Я НЕ3 | Xe (НЕТ3)2 |
| CsNO3 | Ba (НЕТ3)2 | Hf (НЕТ3)4 | Та | W | Re | Операционные системы | Ir | Pt (НЕТ3)2Pt (НЕТ3)4 | Au (НЕТ3)3 | Hg2(НЕТ3)2Hg (НЕТ3)2 | TlNO3Tl (НЕТ3)3 | Pb (НЕТ3)2 | Би (НЕТ3)3BiO (НЕТ3) | По (НЕТ3)4 | В | Rn | |
| FrNO3 | Ра (НЕТ3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла (НЕТ3)3 | Ce (НЕТ3)3Ce (НЕТ3)4 | Pr (НЕТ3)3 | Nd (НЕТ3)3 | PM (НЕТ3)3 | Sm (НЕТ3)3 | Eu (NO3)3 | Gd (НЕТ3)3 | Tb (НЕТ3)3 | Dy (НЕТ3)3 | Хо (НЕТ3)3 | Er (НЕТ3)3 | Тм (НЕТ3)3 | Yb (НЕТ3)3 | Лу (НЕТ3)3 | |||
| Ac (НЕТ3)3 | Чт (НЕТ3)4 | PaO2(НЕТ3)3 | UO2(НЕТ3)2 | Np (НЕТ3)4 | Pu (НЕТ3)4 | Am (НЕТ3)3 | См (НЕТ3)3 | Bk | Cf | Es | FM | Мкр | Нет | Lr |
Описание вещества
Натриевая селитра представляет собой азотный препарат. В его составе присутствует 15-16 % азота и 26 % натрия. По внешнему виду вещество представляет собой белую соль, которая включает мелкие кристаллы. Селитра отлично смешивается с водой. Для более быстрого растворения рекомендуется применять не холодную, а теплую жидкость.
Какие физические свойства проявляет
Нитрат натрия – это далеко не единственное название вещества. Для обозначения этого средства часто применяют такие понятия, как «натриевая селитра» или «азотнокислый натрий». Также его нередко называют чилийской селитрой.
Сегодня соль обычно получают в качестве побочного продукта, который формируется вследствие получения азотной кислоты из аммиака. Удобрение легко смешивается с обычной водой. По мере повышения температуры растворимость увеличивается. При +20 градусах в 100 миллилитрах воды растворяется 87,6 грамма порошка, а при +100 градусах – 176 граммов.
Основные химические свойства
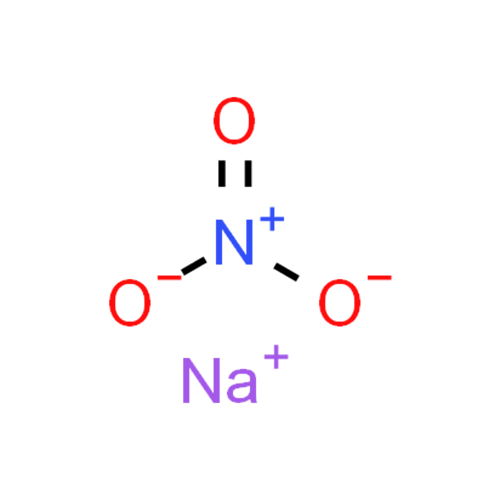
Формула натриевой селитры – NaNO3. Вещество поглощает из воздуха влагу, потому оно сильно слеживается. При этом наблюдаются структурные изменения, а мелкие кристаллы – превращаются в большие. В сухом помещении соль не слеживается и сохраняет свою рассыпчатость. Именно в таком виде ее проще всего вносить в грунт.
В земле азотнокислый натрий распадается на катион Na+ и анион NO3-. Нитрат ион усваивается исключительно биологическим способом. Это происходит осенью и зимой. Однако в силу отсутствия биологического поглощения вещество не остается в почве. Это приводит к потерям азота, особенно на легких по структуре типах почвы. Эта особенность не позволяет применять состав для внесения осенью. При необходимости предзимнего внесения дозировку повышают.
Основные свойства и назначение использования
От того, каким образом проходит получение натриевой селитры, выпускается несколько марок вещества. Только определенный класс может использоваться в аграрном хозяйстве. Этим видом селитры натриевой стала марка СХ, имеющая название «Селитра натриевая техническая марка СХ».
Как добавка к удобрительной смеси запрещено пользоваться маркой А. Так как ее основное назначение металлообрабатывающая, химическая и стекольная промышленность. Класс Б имеет свойства нитрата натрия.
Которые станут полезными для растения и почвы, но основное предназначение такой селитры – осветление стекол и травление металлов. Поэтому и возникает необходимость изучать состав и марку, к которой относится азотнокислый нитрат.

Применение нитрата натрия обусловлено не только применением на производстве или в качестве удобрения на огороде. Его часто используют в качестве пищевой добавки (Е 251) для изготовления колбас, консервации, окрашивания продуктов, как стабилизатор. Его достоинством в данном случае выступает противомикробное свойство.
Натриевую селитру используют в качестве удобрения не так часто, как другие современные препараты. Причина тому: наличие в большем количестве балласта, а не активных веществ. Но рекомендован нитрат натрия в тех случаях, когда определена нехватка главного компонента в грунте. К таким культурам, любящим натрий, стали:
- луковичные растения. В том числе лук, чеснок, декоративные цветы;
- салат (кочанный и листовой), шпинат и сельдерей;
- брюква и ревень, морковь и свекла;
- баклажаны, перец, помидоры и картофель.
Чтобы внесения действительно приносили пользу, внимательно изучается инструкция, проводится тест на наличие нитратов. На частном участке проделать это также можно, как и на больших аграрных фермах.
При использовании селитры главным условием для земледельца остается помнить, что удобрение является сильным окислителем, и совмещение с определенными видами веществ запрещено.

Как промотор или промотор горения или взрыва
Нано3 он используется в качестве окислителя во многих областях. Это твердое вещество, богатое кислородом, которое облегчает процесс воспламенения, выделяя O2.
Наличие NaNO3 позволяет материалам не требовать кислорода из внешних источников для воспламенения, поскольку обеспечивает достаточное количество кислорода2 а также для самоподдержания экзотермических (выделяющих тепло) реакций, которые происходят во время воспламенения или взрыва.
Он давно используется в качестве основного окислителя в пиротехнических материалах (фейерверках), в качестве окисляющего компонента во взрывчатых веществах и детонационных или взрывных веществах, а также в качестве топлива.
Он также используется для улучшения горения угольных кирпичей (брикетов), для улучшения освещения спичек и даже для улучшения горючих свойств табака.
История
Первая партия селитры в Европу прибыла в Англию из Перу в 1820 или 1825 году, сразу после обретения этой страной независимости от Испании, но не нашла покупателей и была сброшена в море, чтобы избежать таможенных сборов. Однако со временем добыча южноамериканской селитры стала прибыльным бизнесом (в 1859 году только Англия потребляла 47 000 метрических тонн). Чили вела Тихоокеанскую войну (1879–1884) против своих союзников Перу и Боливии и захватила их богатейшие месторождения селитры. В 1919 году Ральф Уолтер Грейстоун Вайкофф определил его кристаллическую структуру с помощью рентгеновской кристаллографии .
Вхождение
Самые большие скопления природного нитрата натрия находятся в Чили и Перу , где соли нитратов связаны в месторождениях полезных ископаемых, называемых рудой. Нитраты накапливаются на суше в результате осаждения в виде морского тумана и окисления / осушения морскими брызгами с последующим гравитационным осаждением содержащихся в воздухе NaNO 3 , KNO 3 , NaCl, Na 2 SO 4 и I в жаркой и засушливой атмосфере пустыни. Циклы экстремальной засушливости / проливных дождей Эль-Ниньо / Ла-Нинья способствуют накоплению нитратов как из-за засушливости, так и за счет растворения / ремобилизации / переноса воды на склоны и в бассейны; капиллярное движение раствора образует слои нитратов; чистый нитрат образует редкие жилки. На протяжении более столетия мировые запасы этого соединения добывались почти исключительно из пустыни Атакама на севере Чили, пока на рубеже 20-го века немецкие химики Фриц Габер и Карл Бош не разработали процесс производства аммиака из атмосферы. в промышленных масштабах (см. процесс Габера ). С началом Первой мировой войны Германия начала превращать аммиак из этого процесса в синтетическую чилийскую селитру , которая была так же практична, как и природное соединение при производстве пороха и других боеприпасов. К 1940-м годам этот процесс конверсии привел к резкому снижению спроса на нитрат натрия, полученный из природных источников.
Чили по-прежнему обладает крупнейшими запасами калише с действующими шахтами в таких местах, как Педро де Вальдивия , Мария Елена и Пампа Бланка, и там его раньше называли белым золотом . Нитрат натрия, нитрат калия , сульфат натрия и йод – все это получается при переработке калише. Бывшие чилийские селитровые поселения Хамберстон и Санта-Лаура были объявлены объектами Всемирного наследия ЮНЕСКО в 2005 году.
Методы получения
Взаимодействие гидроксида или карбоната натрия и азотной кислоты
Уравнение реакции:
NaOH + HNO3 = NaNO3 + H2O
Na2CO3 + 2HNO3 = 2NaNO3 + 2H2O + CO2↑
Для получения грамм нитрата натрия требуется грамм гидроксида или грамм карбоната натрия и грамм кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение натрия и перемешивают до его полного растворения, а в случае с карбонатом – до прекращения выделения углекислого газа. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.
Взаимодействие избытка гидроксида или карбоната натрия и нитрата аммония
Уравнение реакции:
NH4NO3 + NaOH = NaNO3 + H2O + NH3↑
2NH4NO3 + Na2CO3 = 2NaNO3 + 2H2O + 2NH3↑ + CO2↑
Для получения грамм нитрата натрия требуется грамм гидроксида или грамм карбоната натрия и грамм нитрата аммония.
В емкость с концентрированным раствором соединения натрия небольшими порциями добавляют горячий раствор нитрата аммония и кипятят при интенсивном перемешивании до прекращения выделения газа и исчезновения запаха.Осторожно, выделяющийся аммиак сильно раздражает глаза и легкие! Процедуру проводить исключительно в вытяжном шкафу или на открытом воздухе!
Взаимодействие хлорида натрия и нитрата аммония
Уравнение реакции:
NH4NO3 + NaCl = NaNO3↓ + NH4Cl
Для получения грамм нитрата натрия требуется грамм хлорида натрия и грамм нитрата аммония.
В емкость с горячим раствором нитрата аммония при кипячении вливают горячий раствор хлорида натрия и перемешивают. При охлаждении смеси выделяется большое количество кристаллического осадка. Осадок отфильтровывают, промывают небольшим количеством холодной воды, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие нитрата кальция или свинца(II) и гидроксида, карбоната или сульфата натрия
При использовании солей свинца возможна замена сульфата натрия на его хлорид.Уравнение реакции:
Ca(NO3)2 + 2NaOH = Ca(OH)2↓ + 2NaNO3
Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Pb(NO3)2 + Na2CO3 = PbCO3↓ + 2NaNO3
Ca(NO3)2 + Na2SO4 = CaSO4↓ + 2NaNO3
Pb(NO3)2 + Na2SO4 = PbSO4↓ + 2NaNO3
Pb(NO3)2 + 2NaCl = PbCl2↓ + 2NaNO3
Для получения грамм нитрата натрия требуется грамм гидроксида или грамм карбоната или грамм сульфата или грамм хлорида натрия и грамм нитрата свинца(II) или грамм нитрата кальция.
В емкость с раствором нитрата кальция или свинца(II) небольшими порциями при перемешивании вливают раствор соли натрия. Выпадает большое количество малорастворимого осадка. Его отделяют отстаиванием и выбрасывают, после чего оставшийся раствор тщательно фильтруют.
Роль в уходе за растениями. Особенности использования
Нитрат натрия представляет собой достаточно агрессивное, по отношению к растениям, соединение. Поскольку используется, как стимулятор роста зеленой массы, его вносят после полного укоренения молодых растений и отрастания новых стеблей и листьев у многолетних культур.
Применяя подкормку, важно следить, чтобы крупнокристаллический порошок не попадала на листья и стебли. Иначе, от полученного ожога они могут страдать и даже погибнуть
По этой же причине не советуют вносить удобрение в непосредственной близости от корней, лучше разбрасывать его в междурядье.
Специалист рекомендуют соблюдать такие правила использования натриевой селитры:
Весной подкормку начинать не раньше, чем среднесуточная температура воздуха достигнет +15 градусов, а почва прогреется до +10, на глубину 20 см.
Гранулы осторожно рассыпать в междурядье после обильного полива.
Удобрение можно оставлять на поверхности почвы, благодаря высокой гигроскопичности оно легко соединяется с влагой и хорошо растворяется без рыхления.
Удобрение содержит большое количество натрия, поэтому его не применяют для растений, которые отрицательно реагирует на избыток этого элемента.
Г. Л. Котова – кандидат с. х. наук,
доцент Кемеровского сельскохозяйственного института.
Общие данные
Нитрат натрия – полноценный консервантный остаток, краситель, который активно используется в мясной продукции. Имеет вид беловатого порошка, либо прозрачных кристаллов. Отличается высокой гигроскопичностью, отсутствием аромата.
Прекрасно растворяется в водных средах, в спирте – гораздо хуже. Нередко элемент именуют натронной селитрой.
По праву нитрат натрия имеет богатую историю. Еще древние жители называли “натрон” озерную щелочь. Даже в те первобытные времена его успешно применяли как консервант для сохранности продукции.
В Европу первая партия нитрата натрия была доставлена в середине 19-го века. Поставщиком в то время выступала страна Чили. К сожалению, ожидаемого фурора не было и товар некоторое время стоял ненужным. А потом мешки просто сбросили в морскую бездну. Но совсем скоро добыча селитры превратилась в настоящую охоту за прибылью.
Структура элемента была определена Уайкоффом в начале 20-го века. С того момента любая страна могла самостоятельно создавать ценное вещество.
Селитра числится во всех актах нормативного плана, нормах и правилах как нитрат натрия. Существует даже специальный ГОСТ, который отвечает за химический тип определения элемента. Но вот общие стандарты соединения для пищевых нужд документация не прописывает. Другие наименования добавки: Е251, чилийская селитра, SodiumNitrate, Natriumnitrat, Natriumsalpeter. Главное обозначение направления – «натрий азотнокислый» – многие указывают на продукции. Цель действия – избежать упоминания вещества кодировки «Е».
Проблемы со здоровьем
Исследования показали связь между повышенным уровнем нитратов и увеличением смертности от некоторых заболеваний, включая болезнь Альцгеймера , сахарный диабет , рак желудка и болезнь Паркинсона : возможно, через повреждающее действие нитрозаминов на ДНК; однако мало что было сделано для контроля других возможных причин в эпидемиологических результатах. Нитрозамины, образующиеся в колбасных изделиях , содержащих нитрат натрия и нитрит, были связаны с раком желудка и раком пищевода . Нитрат и нитрит натрия связаны с более высоким риском колоректального рака .
В последние десятилетия имеются веские доказательства, которым способствовало более глубокое понимание патологических процессов и науки, в поддержку теории о том, что переработанное мясо увеличивает риск рака толстой кишки и что это связано с содержанием нитратов. Небольшое количество нитрата, добавленного в мясо в качестве консерванта, распадается на нитрит, помимо любого нитрита, который также может быть добавлен. Затем нитрит вступает в реакцию с продуктами, богатыми белком (например, с мясом), с образованием канцерогенных NOC ( нитрозосоединений ). NOC могут образовываться либо при вялении мяса, либо в теле при его переваривании.
Однако несколько вещей усложняют простое понимание того, что «нитраты, содержащиеся в пище, повышают риск рака»: общеизвестно, что обычно употребляемые растения являются богатыми источниками нитратов. Фактически, воздействие нитратов из растений может быть даже выше, чем у мяса для большинства людей. Обработанное мясо не содержит клетчатки, витаминов или фитохимических антиоксидантов, с высоким содержанием натрия, может содержать большое количество жиров и часто жарится или готовится при температуре, достаточной для разложения белка на нитрозамины, и обычно не употребляется как часть питательной, сбалансированной диеты. с высоким содержанием клетчатки, витаминов, минералов и тому подобное. Нитраты являются ключевыми промежуточными продуктами и эффекторами в передаче сигналов первичной сосудистой сети, которая необходима для выживания всех млекопитающих.
Меры безопасности и действия при отравлении
Нитрат натрия при контакте с кожей оказывает раздражающее действие на нее. Чтобы избежать этого, при работе с порошком нужно надевать резиновые перчатки. Когда работа закончена, вымыть руки. Обязательно также надевать респиратор и очки, особенно необходим респиратор при самостоятельном приготовлении натриевой селитры.
Нитрат натрия токсичен для человека, может быть опасен при вдыхании или если попадет на слизистые или кожу. Пыль действует раздражающе, может вызвать химический ожог.
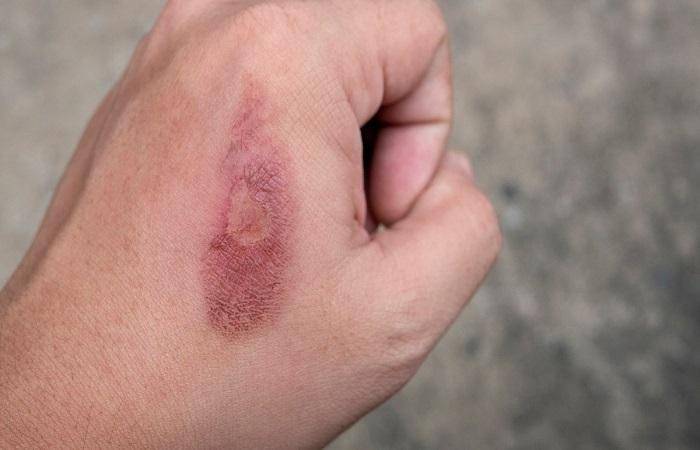
Отравление натрием азотнокислым может происходить, если правила безопасности нарушаются или будет превышена дозировка. При этом наблюдаются такие симптомы: солоноватый с горечью привкус, тошнота, судороги, вялость, боль в зоне печени и в затылке, цианоз.
При появлении симптомов, указывающих на серьезное отравление, нужно безотлагательно обратиться за помощью к врачу. Находиться на свежем воздухе, в тепле, сменить одежду. Промыть кожу водой, глаза – холодной водой в течение 10-30 мин. При попадании раствора в желудок нужно сделать промывание: выпить 6-7 шт. таблеток активированного угля, запить водой. Когда пройдет 20 мин., искусственно вызвать рвоту.
Натриевая селитра – одно из азотных удобрений, используется для подкормки всех культур, но особенно рекомендуется для внесения под корнеплоды и пасленовые – томаты, картофель. Азот в ней содержится в легкоусвояемой растениями нитратной форме. Может использоваться для подщелачивания кислых грунтов. Не рекомендуется для осеннего внесения на легких и затопляемых почвах из-за вымывания в нижние слои грунта.
Другие свойства
Это гигроскопичное твердое вещество, то есть поглощает воду из окружающей среды.
Его растворение в воде приводит к охлаждению раствора, поэтому говорят, что этот процесс растворения является эндотермическим, другими словами, когда он растворяется, он поглощает тепло из окружающей среды, и поэтому раствор охлаждается.
При очень низких температурах нитрат натрия растворяется в жидком аммиаке NH.3, образуя NaNO34NH3 ниже -42 ° С.
Нано3 Он не горюч, но его присутствие ускоряет горение материалов или соединений. Это потому, что при нагревании он производит кислород O2, среди других газов.
Для чего используется нитрат натрия?
Это вещество, которое ещё называют азотнокислым натрием, натриевой селитрой или чилийской селитрой (последнее название отсылает к тому, что впервые вещество в качестве удобрения догадались использовать в Чили, ещё в XIX веке). Ранее удобрение, как и само вещество, добывалось. Сейчас его успешно синтезируют в промышленных объёмах и активно используют для стимуляции роста почти всех сельскохозяйственных культур.
Принцип действия натриевой селитры как удобрения в его щелочных свойствах, а способ применения — смешивание с почвой. Данный химикат может быть произведён в условиях, приближённых к домашним (химическая формула — NaNO3), однако делать этого не рекомендуется, нитрат натрия токсичен и опасен для человека. Удобрение в любых количествах можно купить.
Широкое производство объясняется тем, что помимо аграрной отрасли химикат используется для следующих отраслей:
- тяжёлая промышленность — натриевую селитру в качестве вспомогательного вещества используют в производстве таких важных материалов, как стекло и каучук;
- лёгкая промышленность — в качестве примера можно привести производство лакокрасочных составов и пиротехники;
- азотнокислый натрий — важный компонент ракетного топлива.
Использование нитрата натрия во всех сферах производства требует соблюдения правил безопасности, но специальной квалификации не требуется. Химикат в свободной продаже, а также обеспечить оптимальные (безопасные для людей и окружающей среды) условия хранения.
Виды селитры
Элементы отличаются большим видовым разнообразием. Непосредственно к группе селитры относятся 7 веществ. Это азотнокислые соли натрия, калия, аммония, бария, стронция, кальция, магния. В повседневной практике имеют разные наименования.
- Нитрат аммония. Известен как аммиачная и аммонийная селитра. Химическая формула — NH4NO3. Распространённый способ производства — химическая реакция безводного аммиака (нитрид водорода) и концентрированной серной кислоты. NH3 + HNO3 = NH4NO3. Процесс носит экзотермический характер, то есть выделяется большое количество тепла. Производство вне специальных промышленных зон чревато травмами. Для получения требуемого химического соединения из природного фосфата кальция его превращают в нитрат кальция, отделяют фосфор и соединяют с нитридом водорода. На выходе получается искомый товар.
- Калийная селитра. Употребляемые названия: калиевая, индийская селитра, нитрат калия и азотнокислый калий. Химическая формула селитры — KNO3. В природе залегает в виде минерала нитрокалит. За исключением залежей в Ост-Индии, других крупных ресурсов нет. Поэтому этот вид селитры называют индийской. Нитрат калия не токсичен, гигроскопичность слабая. Практически не слёживается. Разлагается при относительно высокой температуре (500 С). Выделяется нитрит калия (KNO3) и кислород (О2). Существует несколько способов получения продукта в промышленных масштабах. Перспективным считается производство из нитрата магния (MgNO3) и хлористого калия (KCl). Преимущество метода в обилии сырья. Компоненты не относятся к дефицитным. Другой способ — конверсия нитратов аммония и натрия в калиевую селитру.
- Натриевая селитра. Традиционные наименования: нитрат натрия, натронная селитра. Часто употребляется понятие чилийская селитра. Формула — NaNO3. Сильно впитывает влагу, что затрудняет хранение и ограничивает применение в некоторых сферах (изготовление пиротехники). Разложение начинается с T = 380 С. Образуются нитрит натрия (NANO2) и кислород. Свободно вступает в химические реакции с солями щелочных металлов, образуя новые соединения. Обладает сильными окислительными характеристиками. Изготавливается химическим способом путём реакции гидроксида натрия (едкого натра, едкой щёлочи, каустической соды) или кислых натриевых солей с азотной кислотой. Сырьевая база широкая. Дефицита компонентов не ощущается. В природных условиях встречается на месторождениях в Чили. Но они сильно истощены и уже не играют прежней роди. Тем не менее наименование страны прочно укрепилось в селитре.
- Кальциевая селитра. Сопутствующие наименования: нитрат кальция, норвежская (по месту основной добычи), известковая селитра, азотнокислый кальций. Химическая формула — (СaNO3)2. Характерная особенность: самая сильная среди аналогов гигроскопичность. Хранят в сухих местах без доступа влаги. Не горит. При соприкосновенется кислород и Ca (NO2)2. Основной способ выпуска — воздействие азотной кислоты на известняк (CaCO3). Помимо нитрата, этим способом получают чистый оксид кальция — негашёную известь, применяемую в промышленности.
- Нитрат бария. Тот же продукт — бариевая, баритовая селитра. Формула Ba (NO3)2. Главный сырьевой ресурс для получения продукта горно-шахтным путём — минерал нитробарит. Химический метод связан со взаимодействием сульфида бария (ВаS) или карбоната бария (BаCO3) с азотной кислотой. Продукт токсичен, горюч, взрывоопасен.
- Магниевая селитра. Химическая формула Mg (NO3)2. При T = 300 9 C и выше разлагается на оксиды магния (MgOB) и азота. Растворима в воде. Имеет низкую электропроводность. Подвержена горению. Способствует распространению огня.
- Нитрат стронция (стронциевая селитра, азотнокислый стронций). Формула Sr (NO3)2. Получают реакцией карбоната стронция (SrO3) и азотной кислоты. Растворим в воде. При T = 100 С продукт обезвоживается. У него появляются свойства взрывчатого вещества.
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Родентициды – средства защиты от грызунов
Родентициды это средства защиты от грызунов. Их применяют для уничтожения крыс, мышей и некоторых видов диких хомяков. Применять их в качестве уничтожителя начинают в том случае, если грызуны становятся стихийным …
Получение двуокиси хлора из хлорита натрия
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
Схемы с двухступенчатой аммонизацией
На рис. 404 представлена схема производства диаммонитро — фоски (типа TVA). Фосфорная кислота концентрацией 40—42,5% Р2О5 из сборника 1 насосом 2 подается в напорный бак 3, из которого она непрерывно …
Можно ли приготовить натриевую селитру самостоятельно
Чтобы сделать препарат своими руками, рекомендуется взять такие компоненты:
- пищевая или кальцинированная сода;
- горячая вода;
- аммиачная селитра;
- металлическая емкость.
Для приготовления подкормки стоит сделать следующее:
- Соединить соду и аммиачную селитру в пропорции 1:2. При этом непременно нужно использовать средства индивидуальной защиты.
- Добавить горячую воду таким образом, чтобы смесь была покрыта. В результате должна произойти реакция с выходом пузырьков газа и плавным снижением температуры.
- Нагреть состав на паровой бане до окончания реакции. На это потребуется 2 часа.
- Процедить и выпарить жидкость.
Не стоит заниматься приготовлением средства в закрытом помещении. Испарения аммиачной селитры плохо выветриваются и могут оседать на предметах интерьерах. В результате человек будет получать систематическое отравление. Готовить состав рекомендуется на свежем воздухе
При этом важно периодически отходить от емкости с кипящим составом

Свойства
В природе селитра встречается отдельными ромбоэдрическими кристаллами, как правило, сдвойникованными, просто разделяющимися. Но чаще всего она формируется в виде зернистых масс и корочек.
Минерал обладает белым цветом, иногда можно наблюдать бесцветные просвечивающие экземпляры. Но учитывая примеси, оттенок кристаллов может быть желтым или красноватым.
| Описание | Характеристика |
|---|---|
| Сингония | Тригональная |
| Спайность | Совершенная |
| Блеск | Стеклянный |
| Твердость | От 1,5 до 2 |
| Удельный вес | 2.2 |
| Плотность | 2,257 кг/куб. дм. |
| Молекулярная масса | 85 |
Стоит отметить мягкость минерала и ее способность растворяться в воде. Химическая формула селитры NaNO₃.
Техническая селитра в порошке обладает серым или желтоватым цветом и способностью впитывать влагу, потому при хранении следует закупоривать тару во избежание попадания в нее влаги.
При нагревании происходит разложение селитры и высвобождение кислорода, благодаря чему ей прописывают взрывчатые свойства. Температура плавления + 308 градусов С.
Минерал считается сильнейшим окислителем, который относят к третьей степени токсичности.
В процессе влияния на нее высокой температурой с последующей детонацией не исключается взрыв, сопровождающийся выделением едких газов. Потому при контакте с кожей и вдыхании дыма минерал представляет опасность для здоровья человека.

Влияние на конкретные сельскохозяйственные культуры

Влияние на почву и культуры натриевой селитры определяется свойствами нитрат-иона NO3–. Главное условие грамотного применения — вносить азотное удобрение после установления теплой погоды, когда культуры проснулись либо проросли. Нитрат-ионы образуют прочную связь только биогенным путем, а свободные мигрируют в почве с последующим вымыванием.
Когда натриевая селитра вносится по осени, к весне нитрат-ионы углубляются в грунт на расстояние, недоступное для корней растений. Когда снег тает, в земле образуются восходящие токи, но до прогрева поверхностного слоя они скошены, поэтому нитрат-ионы расходятся в стороны, а не к корневой системе. Если речь идет о больших наделах земли, такое свойство можно не брать в расчет, но для маленьких подсобных хозяйств с точечными посадками это чревато поступлением нитратов к растениям, которым они не нужны.
В состав натриевой селитры входит около 17 % азота и примерно 26 % натрия, в малых объемах содержатся бор и марганец, молибден и цинк. Из-за невысокого содержания азота использовать на участке чилийскую селитру рекомендуется только в случае выращивания культур, которым «нравится» натрий. Это растения, которые не так чувствительны к избытку веществ, способны вывести лишний натрий из грунта и не склонны накапливать его в плодах. С учетом эффективности к таким культурам относятся:
- пасленовые (баклажаны и сладкий перец, томаты и картофель);
- морковь;
- брюква, репа, свекла и редис;
- ревень;
- чеснок, лук и декоративные луковичные растения;
- сельдерей, шпинат, кресс-салат.
Луковичные, зелень и картофель способны аккумулировать нитраты в плодах. Учитывая, что сложно определить характер миграции нитрат-ионов на небольших участках, сложно избежать передозировки нитратами. При этом при снижении дозировки культуры могут испытывать дефицит питания. Поэтому опытные аграрии рекомендуют выращивать на участке, удобренном чилийской селитрой, луковичные цветы или корнеплоды. Применяют селитру в таком случае по типовой схеме внесения азотсодержащих удобрений.
Использует
Нитрат натрия можно сочетать с серная кислота производить азотная кислота, который отгоняется. При более низком давлении необходимая более низкая температура приводит к меньшему разложению. Теоретические 2 моля азотной кислоты на 1 моль серная кислота приводит к очень высокой конечной температуре, сильному разложению и твердому нейтральному сульфату, который трудно удалить. Когда эта реакция имела промышленное значение, обычной практикой было оперировать серная кислота в избытке, чтобы получить продукт, в основном бисульфат, вылитый из реторты.
Любитель переработчики золота используют нитрат натрия, чтобы сделать гибрид царская водка который растворяет золото и другие металлы.[нужна цитата ]
Менее распространенные применения включают в себя окислитель в фейерверках, заменяя азотнокислый калий обычно встречается в черный порошок, и как компонент в холодных компрессах быстрого приготовления.
Нитрат натрия используется вместе с нитратом калия и нитрат кальция для хранения тепла и, в последнее время, для теплопередача в солнечная энергия растения. Смесь нитрата натрия, нитрата кальция и нитрата калия используется в качестве материала для хранения энергии на установках-прототипах, таких как Солнечная электростанция Andasol и проект Архимеда.[нужна цитата ]
Он также используется в очистке сточных вод для факультативного дыхания микроорганизмов. Нитросомонады, род микроорганизмы, предпочтительнее кислорода потребляет нитрат, что позволяет ему быстрее расти в очищаемых сточных водах.
Нитрат натрия также иногда используется морскими аквариумистами, которые используют методы дозирования углерода. Он используется для повышения уровня нитратов в воде и способствует росту бактерий.[нужна цитата ]
Еда
Нитрат натрия также пищевая добавка используется в качестве консерванта и фиксатора цвета в колбасах и птице; он указан в Номер INS 251 или Номер E E251. Он одобрен для использования в ЕС, НАС и Австралия и Новая Зеландия. Нитрат натрия не следует путать с нитрат натрия, который также является обычной пищевой добавкой и консервантом, используемым, например, в мясных деликатесах.
Существуют ли противопоказания и срок годности
Нитрат натрия не стоит использовать на солончаках или в засоленном грунте. В этом случае рекомендуется выбрать другой препарат с аналогичными свойствами. При комбинированном применении вещество нельзя сочетать с перегноем и средствами на основе фосфора и калия. Также препарат запрещено применять в телицах.
Срок хранения натриевой селитры не ограничен. Ее разрешается держать исключительно в заводской упаковке, которая не пропускает влагу. Нельзя хранить рядом органические подкормки, пищевые продукты и бытовые средства. Помимо этого, вещество должно находиться вне зоны доступа детей и домашних животных.
При нагревании подкормки есть вероятность взрыва или возгорания. Потому препарат требуется изолировать от горючих средств и герметично закрыть. Мешки с порошком должны находиться на поддонах.